Que recherchez-vous ?
Un contenu sur ce site
Une personne sur l'annuaire
Une formation sur le catalogue
Un contenu sur ce site
Une personne sur l'annuaire
Une formation sur le catalogue
Responsable : Sébastien BROT
L’ultramicroscope (LaVision Biotec) est un microscope à fluorescence basé sur une illumination par feuillet de lumière. L’éclairage s’effectue donc perpendiculairement au plan d’acquisition par une feuille de lumière comprise entre 4 et 10 µm d’épaisseur et de la largeur de l’ensemble de l’échantillon.
Afin de limiter les artefacts la feuille de lumière est divisée en trois sous-faisceaux qui convergent vers l’échantillon avec des angles différents, ce qui permet d’éviter les phénomènes d’ombrage courant avec cette technique. Le microscope est équipé d’une caméra très sensible (CMOS) et très résolutive (2560×2160 pixels par image). Les grandissement disponibles (de 1.26 à 12.6 X) permettent une exploration optimale d’organe entier jusqu’aux niveaux cellulaire. Il est équiper de 4 lasers diodes : 488nm, 561 nm, 639nm et 785nm. Cette technologie implique d’utiliser des échantillons clarifiés dont les techniques de production sont maintenant bien établie. La taille du volume que l’on peut imager est de l’ordre du centimètre cube à une résolution de l’ordre du micromètre dans le plan et de 3 micromètre en profondeur. Réservation via ImageUP

Le microscope Axio Imager 2 est équipé de 6 filtres pour la fluorescence, d’une caméra ultrasensible Orca4 Flash de chez Hamamatsu, et de la dernière version du logiciel ZEN pour l’acquisition. Le microscope est équipé d’un module apotome afin de pouvoir créez des coupes optiques des échantillons fluorescents, exemptes de lumière diffusée. Avec une illumination structurée, seul le plan focal apparaît dans l’image. Une méthode totalement fiable pour empêcher la lumière diffusée hors plan focal, même dans les échantillons les plus épais. Les images obtenues sont fortement contrastées avec la meilleure résolution possible.
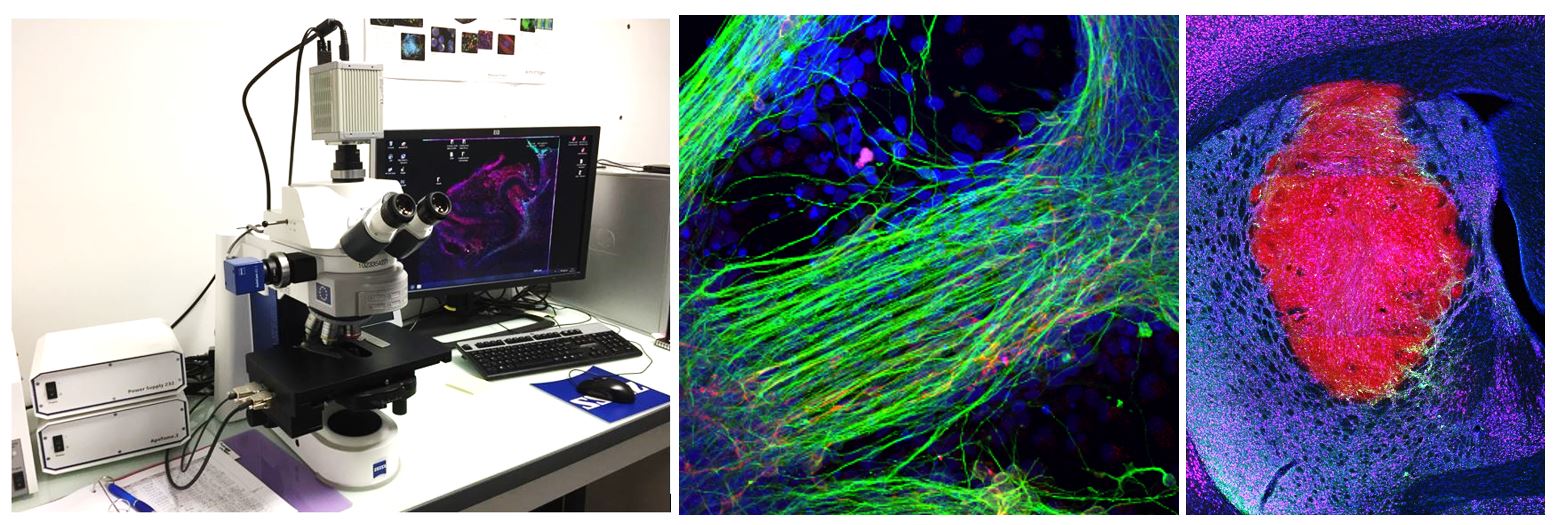
L’Axio Zoom.V16 combine un zoom 16x avec une ouverture numérique élevée (NA> 0,25). Ce macroscope permet l’observation d’échantillons fluorescents (ou non) à un niveau macroscopique (de quelques cellules aux organismes entiers). Des images de très bonne qualité peuvent être obtenues à partir d’échantillons sous lame/lamelle, mais aussi au travers de boîtes de Pétri (ex : embryons). Cet appareil permet de faire l’acquisition d’une image de coupe de cerveau de rongeur en quelques secondes.
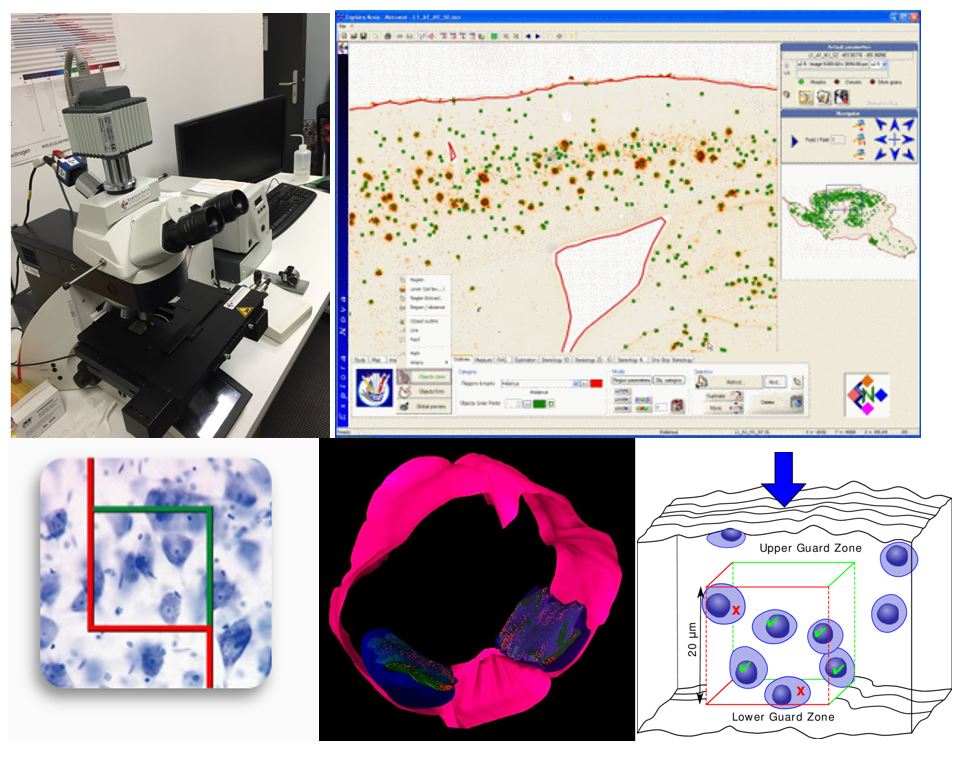
Mercator est un logiciel complet pour la quantification des coupes histologiques. Il permet de définir les contours des régions d’intérêt à faible grossissement et de quantifier les cellules à fort grossissement. Il permet de faire des évaluations morphologiques, colorimétriques, densitométriques, ainsi que de l’analyse stéréologique. Mercator élimine également le risque de double comptage, et peut générer des cartes à haute résolution.
Imaris est un logiciel propriétaire de reconstruction 3D/4D, édité par la société Bitplane.
Il permet de visualiser, les images prises en microscopie photonique, par reconstruction volumique et surfacique. Le laboratoire possède sa propre licence d’Imaris (version 9.3), notamment pour analyser les données obtenues avec le microscope à feuille de lumière.
Modules disponibles :
Responsable: Eric Balado


 Les cages d’environnement enrichi modélisent l’effet d’un environnement stimulant pour l’animal par opposition à l’environnement pauvre fourni par les cages standards. En effet ces cages offrent aux rongeurs plus de possibilités d’interactions sociales, de comportement exploratoire et d’activités physiques.
Les cages d’environnement enrichi modélisent l’effet d’un environnement stimulant pour l’animal par opposition à l’environnement pauvre fourni par les cages standards. En effet ces cages offrent aux rongeurs plus de possibilités d’interactions sociales, de comportement exploratoire et d’activités physiques.
Responsable : Marianne Benoit-Marand
La plateforme d’électrophysiologie comprend deux postes d’enregistrement in vivo et deux postes d’enregistrement sur tranche de cerveau.
Les équipements d’électrophysiologie in vivo permettent l’enregistrement extracellulaire de l’activité unitaire en potentiels d’action des neurones chez le rongeur anesthésié. Le marquage des neurones par la neurobiotine lors de l’enregistrement permet de les identifier a posteriori.
Enregistrement in vivo
Le poste d’électrophysiologie sur tranche comprend un système de coupe permettant la réalisation de tranches de cerveaux et un système d’acquisition permettant l’enregistrement en patch-clamp des neurones. Cette technique permet l’étude des propriétés membranaires et des réponses synaptiques neuronales
Enregistrement en tranche
La plateforme d’histologie regroupe différents appareils de coupe afin de s’adapter à un maximum d’échantillons et d’applications : trois microtomes, trois vibratomes et deux cryostats. Cette plateforme est utilisée par l’ensemble des membres des trois équipes du LNEC.
 Elle permet d’obtenir des coupes de cerveaux de rats ou de souris afin de réaliser notamment des expérimentations d’immunohistochimie ou d’hybridation in situ.
Elle permet d’obtenir des coupes de cerveaux de rats ou de souris afin de réaliser notamment des expérimentations d’immunohistochimie ou d’hybridation in situ.
En 2013, les congélateurs contenant des échantillons biologiques et les anticorps ont été équipés avec le système d’alarme SIRIUS (JRI). Sirius est un logiciel dédié à la surveillance des températures d’une installation fixe.
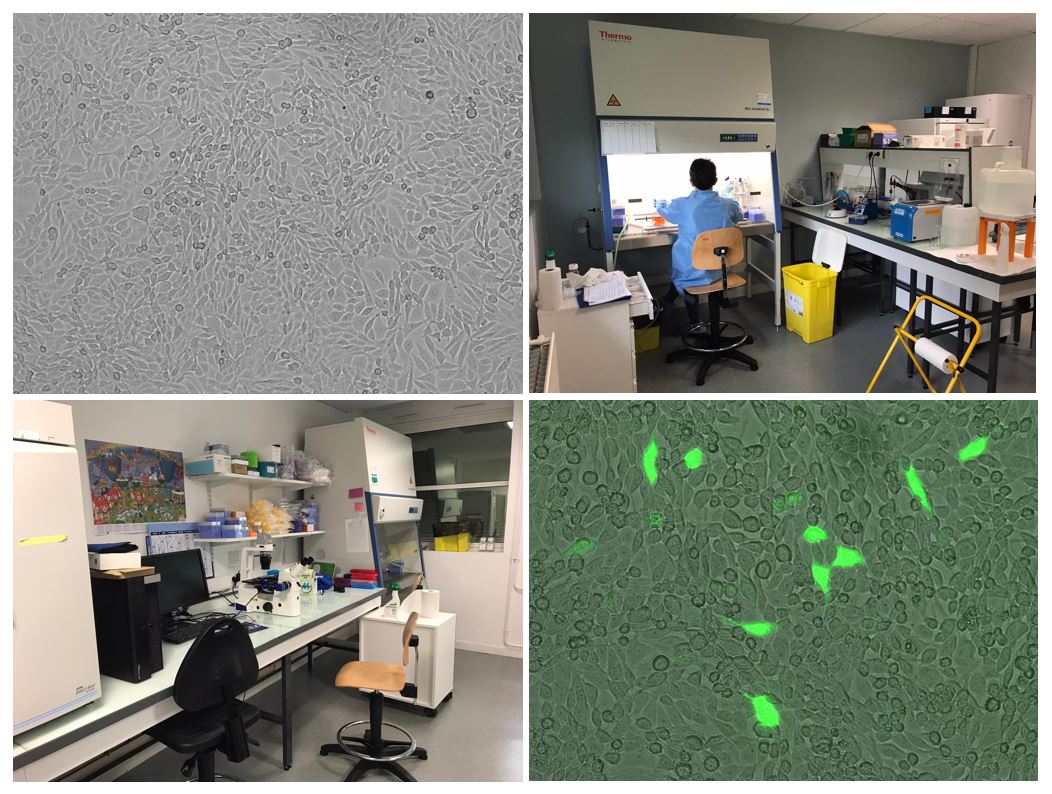
Le laboratoire possède deux pièces de culture cellulaire avec un agrément du HCB de niveau C2. Pour réaliser les différents projets de culture cellulaire, les pièces sont équipées :
La plateforme est principalement utilisée par les membres de l’équipe 1 (A. Gaillard) pour le développement de protocoles de différenciation de cellules souches en précurseurs neuronaux, dans le cadre de greffes dans différents modèles animaux. Cette plateforme est également utilisée dans les projets sur les glioblastomes et sur la dégénérescence maculaire liée à l’âge.

La plateforme de culture cellulaire est également utilisée par les membres de l’équipe 3 (P.O. Fernagut) pour la mise au point et le développement de nouvelles études nécessitant la transfection de cellules murines avec des ShRNA et la culture primaire de neurones murins.
Responsable : Virginie Lardeux
La plateforme d’HPLC est composée d’un système HPLC indépendants avec un détecteur électrochimique. L’injection et l’analyse chromatographique des échantillons sont contrôlées par ordinateur. Cette plateforme est utilisée pour mesurer les concentrations de neurotransmetteurs et de leurs métabolites obtenus grâce à la microdialyse in vivo ou dans des échantillons de cerveaux

Système HPLC